膜片钳技术是一种细胞内记录技术,是研究离子通道活动的最佳工具,也是应用最广泛的电生理技术之一。该技术通过施加负压将微玻管电极(膜片电极或膜片吸管)的尖端与细胞膜紧密接触,形成GΩ以上的阻抗,使电极开口处的细胞膜与其周围膜在电学上绝缘。被孤立的小膜片面积为μm量级,内中仅有少数离子通道。玻璃微电极中含有一根浸入电解溶液中的导线,用于传导离子。在此基础上对该膜片施行电压钳位(即保持跨膜电压恒定),如果单个离子通道被包含在膜片内,则可对此膜片上的离子通道的电流进行监测记录。通过观测单个通道开放和关闭的电流变化,可直接得到各种离子通道开放的电流幅值分布、开放几率、开放寿命分布等功能参量,并分析它们与膜电位、离子浓度等之间的关系。还可把吸管吸附的膜片从细胞膜上分离出来,以膜的外侧向外或膜的内侧向外等方式进行实验研究。这种技术对小细胞的电压钳位、改变膜内外溶液成分以及施加药物都很方便。
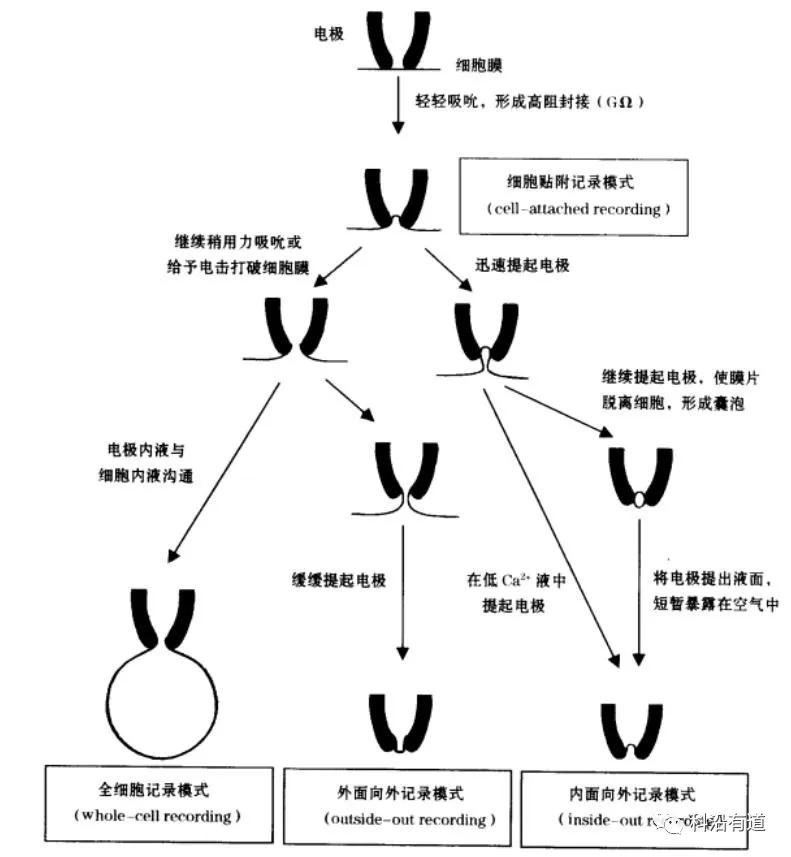
在膜片钳技术的发展过程中主要形成了五种记录模式,即细胞贴附模式(cell-attachedmode或loose-seal-cellattached mode)、膜内面向外模式(inside-out mode)、膜外面向外模式(outside-out mode)、常规全细胞模式(conventional whole-cell mode)和穿孔膜片模式(perforated patch mode)。
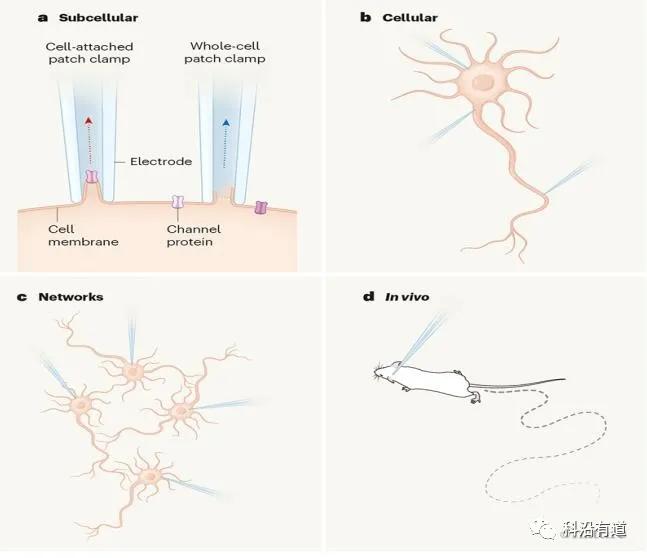
a.亚细胞水平:细胞贴附模式,可记录通过电极下膜片中通道蛋白的离子电流(红色虚线箭头)。在全细胞膜片钳中,膜片破裂,因此可以记录全细胞的宏观电流,它表示整个细胞的总和电流 (蓝色虚线箭头)。
b.细胞水平:来自神经元不同部分的全细胞同步记录可确定信号传递的方向。
c.神经元网络水平:全细胞记录可以在一个连接神经元的小网络中进行。
d.活体水平:可以在执行任务或自由走动的动物大脑中进行全细胞记录。
1、细胞膜离子通道的性质鉴定及其动力学研究;
2、单细胞形态与功能研究;
3、药物作用机制研究;
4、细胞分泌的研究;
5、信号转导的研究;
6、分子生物学研究。
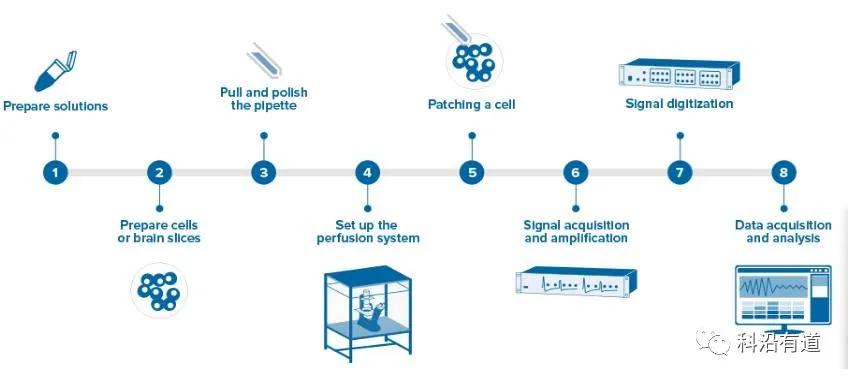
需求沟通→方案定制→样本寄送→膜片钳记录→数据分析→交付结果。
1、检测需求及参考资料;
2、实验模型/样本;
3、分析方法。
1、检测报告;
2、原始数据。
北京科沿有道生物科技有限公司,专注于生命科学最前沿科研技术服务,具有较好的生物学和医学技术服务平台,能够提供细胞实验、动物模型、病理检测、分子实验、免疫检测、病毒包装、组学服务、基因编辑等整体课题一站式服务。
科沿有道秉承“客户为先,服务至上”的经营理念,以一切为了客户的利益为宗旨,努力为广大客户提供最优质、高效的服务,科沿有道人用实实在在的优质实验技术换取客户的信任,相信在未来的工作中,科沿有道人一定能够成为您的得力助手和值得信赖的合作伙伴。
各类实验标本要求
比较蛋白质组学之SILAC定量分析
比较蛋白质组学之Label-free定量分析
比较蛋白质组学之iTRAQ定量分析



评论