病理染色实验——免疫组化染色
实验介绍
免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。
实验步骤
(1)切片脱蜡:将石蜡切片依次放入二甲苯Ⅰ(10min)-二甲苯Ⅱ(10min)-无水乙醇Ⅰ(5min)-无水乙醇Ⅱ(5min)-95%酒精(3min)-90%酒精(3min)-80%酒精(2min)-70%酒精(2min),然后蒸馏水浸洗2min。
(2)抗原修复:切片放入配置好的足够量的修复液(0.01M枸橼酸缓冲液,pH6.0)中,放在高温的电磁炉上修复时间为10-15min,室温放置40min左右冷却降温,当修复液降至室温后取出玻片,用PBS(PH7.4)冲洗3遍,每次3min。
(3)阻断内源性过氧化物酶:3%的过氧化氢滴加于切片组织,室温孵育15min,PBS冲洗3次,每次3min。
(4)血清封闭:滴加稀释好的正常山羊血清,室温封闭30min,以减少非特异性染色。
(5)加一抗:滴加稀释好的一抗,加完一抗后于4°C湿盒中孵育过夜。
(6)加酶标二抗:PBS冲洗切片3次,滴加HRP标记的山羊抗兔/小鼠二抗,室温或37℃孵育20min。
(7)加显色剂:PBS冲洗切片4次,滴加DAB显色液。
(8)复染:Harris苏木素复染,一般30s-1min左右,水洗后用1%的盐酸酒精分化,再用自来水(或PBS)水洗返蓝。
(9)脱水:将切片置于水中冲洗后,将切片依次放入70%酒精-80%酒精-90%酒精-95%酒精-无水乙醇Ⅰ-无水乙醇Ⅱ-二甲苯Ⅰ-二甲苯Ⅱ中脱水透明。
(10)封片:将中性树胶滴在组织旁边,再用盖玻片盖上,镜检拍照。
实验案例
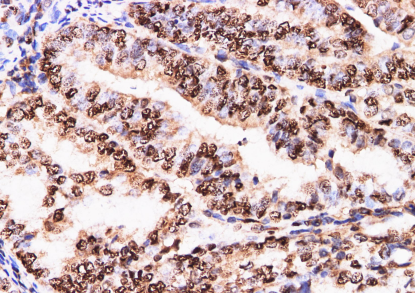
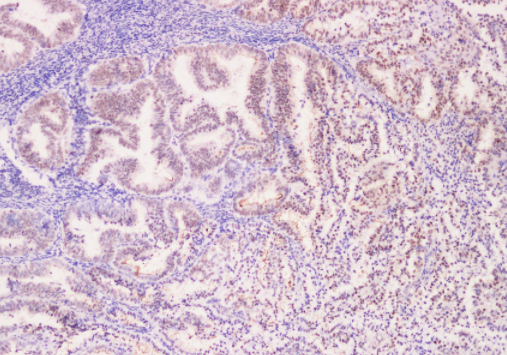
多肽组学简介
常规组织脱水与石蜡包埋
普鲁士蓝染色简介
PKH26染色简介



评论