分子实验——荧光定量PCR检测
实验介绍
实时荧光定量PCR(Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。
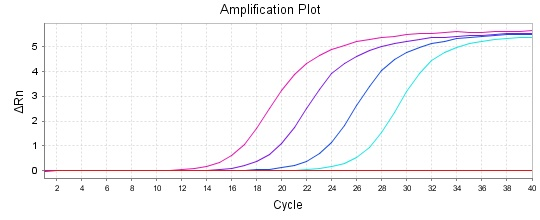
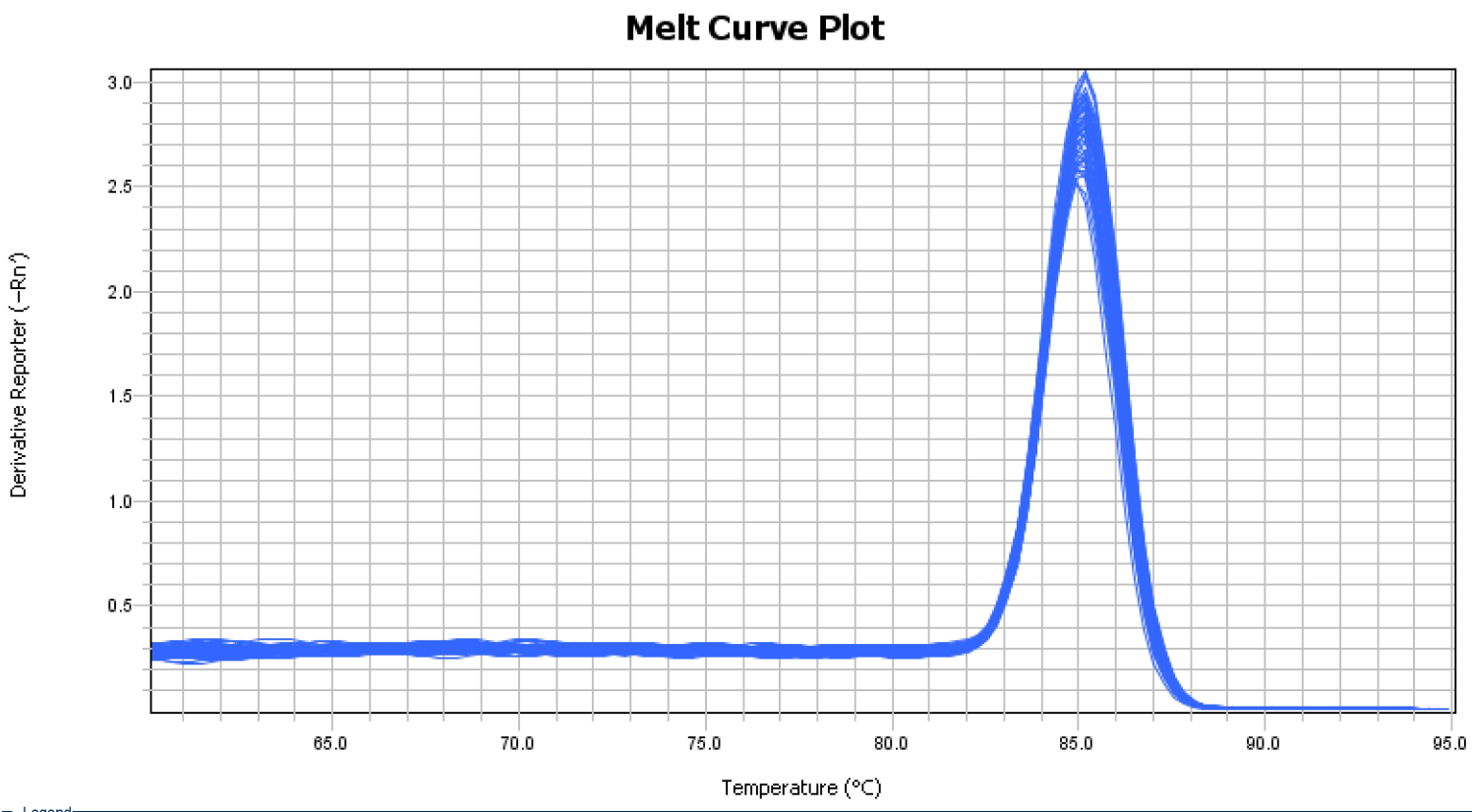
在常做的QPCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
在Real-timePCR中,模板定量有两种策略,相对定量和绝对定量。
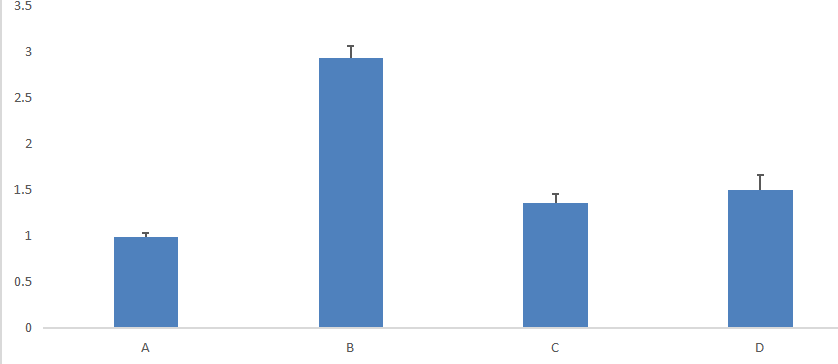
相对定量是用于测定两个或多个不同样品中靶基因量的差异,得到的数据是目的基因在各样本中含量的相对比例。即将实验样本中靶基因的Ct值与对照样本的Ct值进行比较,结果用实验样本中靶基因量与对照样本中靶基因量的比值或差异倍数来表示。该方法在qPCR定量检测mRNA水平中最常见,研究生理变化对基因表达水平的影响。
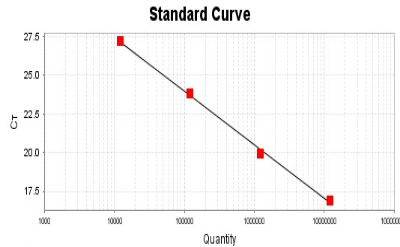
绝对定量常用于精确计算初始模板中目的基因的浓度,比如测定血液样品中病毒颗粒数(DNA或RNA),细胞中基因的拷贝数等,得到的数据是单个样本的定量描述,不依赖于其他样本。理想情况下,Ct值与模板起始拷贝数的对数存在线性关系,这种关系表现在图上就是标准曲线(下图)。绝对定量的检测即根据标准曲线对未知样品进行的定量。
实验步骤
相对定量QPCR
1.RNA提取:采用TRNzol总RNA提取试剂进行样本RNA提取,实验操作按产品说明书进行;
2.RNA质量检测:使用NanoDrop® ND-2000测定RNA浓度和纯度,同时电泳跑胶鉴定;
3. 逆转录合成cDNA:采用PrimeScript™ RT reagent Kit with gDNA Eraser进行cDNA反转录,实验操作按产品说明书进行;

4. RealTime PCR样本检测
(1)将所有cDNA样品分别配置Realtime PCR反应体系。体系配置如下:
2 × Master Mix:10 µl
10uM 的PCR特异引物F :0.5µl
10uM 的PCR特异引物R:0.5µl
加水至总体积为:18µl
样本:2µl
(2)将上述96-PCR板置于Realtime PCR仪上进行PCR反应。
绝对定量QPCR
1.土壤样本基因组DNA提取:实验操作按产品说明书进行;
2.标准品质粒构建
(1)以客户提供样本为模板,用目的基因引物进行PCR扩增;
(2)TA克隆:回收的PCR产物进行TA连接;
(3)菌落PCR鉴定阳性克隆,测序;
3.RealTime PCR样本检测
(1)将所有cDNA样品分别配置Realtime PCR反应体系。体系配置如下:
2 × Master Mix:10 µl
10uM 的PCR特异引物F :0.5µl
10uM 的PCR特异引物R:0.5µl
加水至总体积为:18µl
样本:2µl
(2)标准品配置
将质粒标准品从101-105进行10倍梯度稀释,每个梯度取2ul做模板建立标准曲线。
(3)将上述96-PCR板置于Realtime PCR仪上进行PCR反应。
实验案例
分子互作之核酸与蛋白互作
分子互作之核酸与核酸互作
RIP常见问题与解答
多肽组学简介



评论